安倍政府が米バイオ製薬大手ギリアド・サイエンシズの開発する新薬「レムデシビル」を、今月上旬にも初の新型コロナ治療薬として承認・使用する動きを見せている。通常の承認制度の手続きは1年以上かかるため、新薬の承認制度を閣議だけで改悪し、レムデシビルに「特例承認制度」を適用する手続きを開始した。新型コロナ治療をめぐっては、富士フイルム富山化学が開発した「アビガン」を国がすでに一定量備蓄しており、治療効果も確認されているため、医療現場で幅広い活用を求める声があいついでいた。だが安倍政府はアビガンの早期承認は引き延ばし続け、日本国内の治験が始まったばかりで、治療効果も十分確認されていない米国製新薬をスピード承認し、今月中の使用に踏み切ろうとしている。
レムデシビル
安倍首相は4月27日、新型コロナウイルス感染症の治療薬候補「レムデシビル」に関連して「まもなく薬事承認が可能となる見込みだ」と衆院本会議で明言した。菅義偉官房長官も翌日、閣議後の会見で「国際共同治験を実施してきたレムデシビルはまもなく薬事承認が可能となる見込みだ」と強調した。同時に「特例承認制度は海外で販売が認められる等、一定の要件を満たす医薬品が対象」であり「海外で新型コロナウイルス感染症に関して販売が認められていないアビガンに適用することは困難」と強調した。それは「アビガンは特例承認対象ではなくレムデシビルを日本国内の新薬として認める」という方針を海外、とりわけ米国にアピールする内容だった。
現在、新型コロナウイルス感染症の治療薬開発は世界各国が研究を急いでおり、「既存薬の転用」と「新薬の探索」の両にらみで研究が進んでいる。このうちヒトへの投与経験がある「既存薬の転用」の方が早期活用の実現性は高く、臨床試験結果が数カ月以内に得られる見通しになっていた。なお臨床試験が進んでいる主な候補薬は次の8種類である。
【海外の薬】
▼レムデシビル(米ギリアド・サイエンシズ、エボラ出血熱薬)
▼カレトラ(米アッヴィ、HIV感染症薬)
▼クロロキン(独バイヤー、マラリア感染症薬)
▼プラケニル(仏サノフィ、全身性エリテマトーデス薬)
【日本の薬】
▼アビガン(富士フイルム富山化学、抗インフルエンザウイルス薬)
▼フサン(日医工、急性膵炎治療薬)
▼オルベスコ(帝人ファーマ、気管支ぜんそく治療薬)
▼トシリズマブ(中外製薬、リウマチ治療薬)
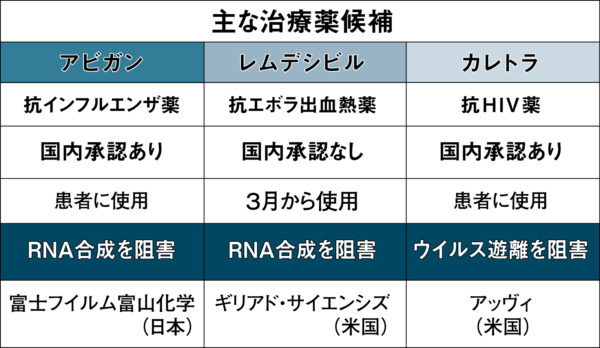
このうち日本で早くから注目を集めてきたのがアビガン、レムデシビル、カレトラ【主な治療薬候補の表参照】だった。なかでも一定量の備蓄と治療実績があるアビガンは国内外からすぐに投与を開始できる新型コロナ治療薬として、強い期待を集めた。
アビガンは保険適用外 海外には無償供与
アビガンは2014年に製造・販売の承認を得て「国が新型インフルエンザの流行に備えて備蓄する特殊な治療薬」と位置づけた国産薬だ。一般的に出回っていないが国の正式な治験をへて治療効果や副作用を確認し、緊急時は活用できると認めている薬だ。そのため「タミフルなど既存インフルエンザ治療薬が効かないときに投与を開始する薬」として政府が200万人分備蓄し、いつでも使える状態になっていた。
さらにアビガンは従来の抗ウイルス薬とは違うメカニズムになっている。インフルエンザや新型コロナなどを含むRNA(リボ核酸)ウイルスの増殖は次のような三段階を経る。
①人の粘膜にくっついて細胞内に入り込み、細胞のなかで自身の膜を破ってウイルスの設計図であるRNA(リボ核酸)を放出(脱穀)
②放出されたRNAが細胞内でウイルスを生み増えていく(複製)
③そのウイルスが酵素の力を借りて細胞の外に飛び出ていく(遊離)
従来の抗インフルエンザ薬は最後の「遊離」段階でウイルスが細胞外へ飛び出ていくのを妨害する薬だが、アビガンはウイルスの複製を助ける酵素(RNAポリメラーゼ)を妨害しウイルスの「複製」を阻止する。それはできたウイルスをブロックする従来の薬と違い、「ウイルスが増殖するまえに細胞内でつぶす薬」であるため、インフルエンザ以外の多様なウイルスにも効果があると指摘されてきた。
アビガン
実際にアビガンは2014年に西アフリカで大流行したエボラ出血熱の治療でも効力を示し、中国での新型コロナウイルス感染治療でも効力を発揮している。日本国内では「新型コロナ治療薬として認められていない」という理由で、いまだに「治験」目的でしか使えないが、それでも1100の医療機関が2000人以上の新型コロナ患者に投与し、治療効果が確認されている。アビガンには胎児に影響を及ぼす副作用があり、妊婦に投与できないという特徴もある。それでも約80カ国以上がアビガンの提供を日本に要請している。
そのため医療現場や地方自治体もアビガンの早期投与を強く要求している。
日本医師会は先月末、重症化するリスクの高い高齢患者などへのアビガンの早期投与を推進するよう自民党に要望書を提出した。
同会の横倉義武会長は記者会見で、新型コロナウイルスに感染した人で症状が急速に悪化する事例があることにふれ、「高齢者のほか、高血圧などの循環器疾患のある方や糖尿病の方、あるいは喘息や慢性閉塞性肺疾患などの呼吸器疾患をお持ちの方、がんや各種免疫不全などの基礎疾患を有する方は重篤化しやすい。ハイリスクの方はより早期に対応することが必要」「中国でも感染した早期に抗ウイルス剤を投与してウイルスの増殖を止めることが非常に良かったという報告もある」と指摘。「政府がアビガンの備蓄を増やしている状況を鑑み、副作用などを十分に注意することを前提としてアビガンを活用し、入院初期のハイリスク者に対する投与を推進していただきたい」と強調した。
福岡市と九州大病院、福岡大病院も先月、アビガンを現場医師の判断で投与できるように求める要望書を加藤勝信厚生労働相宛てに提出した。要望書では、日本感染症学会でアビガンを投与した軽症や中等症の患者の9割、重症患者の六割に新型コロナ感染症の改善が認められたと報告されたことも明らかにした。
神奈川県の黒岩祐治知事は2月段階で「新型コロナウイルス治療薬に関する緊急要望」を菅官房長官、加藤厚労相宛てに提出した。
そこでは「新型コロナウイルスに感染し、苦しむ多くの方々の治療のために、国としてただちにアビガンの治験・臨床研究を開始し、迅速な承認に向けたとりくみをすすめていただきたい」と要請している。
ところが日本国内でアビガンを活用する動きは鈍い。富士フイルム富山化学が3月31日から日本で臨床試験の最終段階となる第三相臨床試験に着手し、PCR検査で新型コロナ陽性となった患者(20歳~70歳、96例を目標)を対象にアビガンの効能を試しているが試験終了は6月末の予定だ。しかもそのデータを分析して国側が審査手続きを終えるのは1~2年後という。仮に特例の措置で承認したとしても使用できるのは今年夏頃になると見られている。
茂木敏充外相は1日、アビガンをフィリピンやマレーシア、オランダなど43カ国に無償供与(供与は総額100万㌦からなる政府の緊急無償資金協力の枠組みで実施)する調整を終えたと明らかにしたが、国内で活用する体制整備は遅々として進まないのが実態である。
しかも一カ国に供与する量は「原則20人分、最大100人分」とし、日本への臨床データ提供を求めている。世界各国へのアビガン提供も、新型コロナ患者の多い地域で積極的に投与して感染拡大を封じ込めていく姿勢ではなく、小出しにして恩を売るような対応になっている。
投与対象は重症者限定 感染抑止に繋がらず
こうしたなか、前例のない異常なスピード承認へ動き出したのがレムデシビルだ。レムデシビルは米ギリアド・サイエンシズがエボラ出血熱の治療用に開発していた抗ウイルス薬(注射薬)だが、エボラの治療では安全性と有効性が確認されず、どの国でも認可されていない。しかし「動物(アフリカミドリザルやアカゲザル)を用いた実験で新型コロナウイルスへの有効性を示すデータが得られた」という情報が出回り、新型コロナ治療薬候補として注目され始めた。そのなかで米国立衛生研究所(NIH)や日本の国立国際医療研究センターなどが新型コロナ関連の治験をおこなってきた。だが具体的な情報はほとんど公開されずに来た。薬の構造も「RNA合成を阻害する薬」と報じられているが、詳細は不透明だ。
そして日本での臨床試験は4月14日に始まったばかりである。ギリアド・サイエンシズ自身も4月中旬段階で「レムデシビルは世界のいずれの国においても認可・承認されておらず、いずれの適応でもその安全性や有効性は確立されていません」(4月14日付、広報資料より)と明らかにしており、とても十分な治験がおこなわれたといえる状況ではない。
しかも中国などのグループが4月29日に医学誌ランセットで発表した湖北省での臨床試験結果は「レムデシビルを使う158人とプラセボ(偽薬)を使う79人のあいだで、症状改善までの日数、死亡率ともに統計的に意味のある差はなかった」「レムデシビルのグループは貧血、血小板減少症などの副作用が見られた。28人が急性呼吸不全などを起こして重篤化し、18人が臨床試験を中止した」というもので、早期承認に疑問や懸念を残す内容だった。
こうしたなか、米国の早期承認にむけた動きが加速した。米国立アレルギー感染症研究所(NIAID)は4月29日、ホワイトハウスでレムデシビルの大規模な臨床試験の結果、プラセボと比べ新型コロナ患者の回復を30%以上早めることが示されたと発表した。
この試験を監督する同研究所のアンソニー・ファウチ所長(米トランプ政府によるワープスピード作戦…ワクチン開発を早急に進める米国政府の新型コロナ対策の一つを主導)は「レムデシビルには回復までの期間を短縮させる点において、明確かつ有意で、好ましい効果があることがデータで示された」「とてもいいニュースだ。治療の標準になり得る」と表明した。ギリアド・サイエンシズも同日、重度の新型コロナ入院患者にレムデシビルを投与したところ10日後に50%で症状が改善し、2週間以内に半数以上が退院したという結果を発表した。
このレムデシビルは、少なくとも7900万㌦(約87億円)の政府資金を投じて開発してきたトランプ政府肝入りの抗ウイルス薬にほかならない。そのためトランプ政府はギリアド・サイエンシズのレムデシビル開発に七年間の独占権を与えている。すでにギリアド・サイエンシズは向こう7年間、多くの患者が購入しやすいジェネリック薬品の開発を妨げたり、独占的に医薬品の価格管理を設定したり、助成金や税額控除の恩恵を得られる体制を米国内で整えている。
そのためトランプ大統領は4月30日にホワイトハウスで「これまで見たことの無いような近道でワクチンを開発したい」とハッパをかけた。
それを受けて米食品医薬品局(FDA)は1日、レムデシビルの緊急使用を認可した。FDAは人工呼吸器を使うなど重症の入院患者を投与対象とし、副作用として肝臓の炎症、細胞損傷、低血圧、吐き気、発汗、悪寒などをあげている。ただ、FDAの緊急使用認可は、新薬の有効性を正式に確認した「承認」ではない。「緊急性が高い」などの一定の条件を満たせば、特例として使用を認めるという「緊急認可」である。そのためFDAも「コロナ患者に対する安全性や効用に関する情報は限られている」とし、今後も治験が必要な薬と見なしている。
米国各地の医療機関では四日からレムデシビル14万人分の無償提供が始まる。だが投与対象はすでに重症化した患者限定である。軽症の患者に投与して副作用があいつげば大問題になるが、最初から重症の患者であれば、副作用で死亡しても大きな問題にはなりにくい。投与対象がなぜ重症患者限定なのかも厳密な検証が不可欠といえる。
承認手続き大幅に緩和 「米国製のみ」の疑問
このようなレムデシビルの特例承認【特例承認の図】を急いでいるのが安倍政府である。特例承認とは、①国民の生命及び健康に重大な影響を与える恐れがある疾病が蔓延し緊急に使用する必要がある、②日本と同等の審査水準がある外国で承認されている、という条件を満たせば、通常は1年かかる国内での審査手続きを経ずに審査期間を大幅に短縮できる制度である。
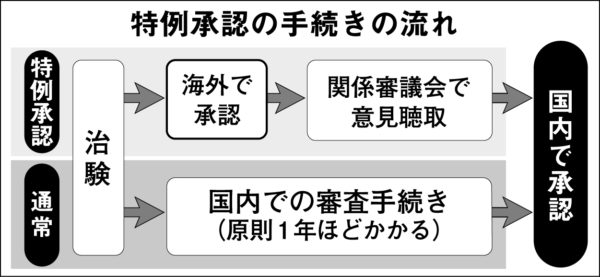
しかし「医薬品医療機器等法」に基づく特例承認は、外国のどんな医薬品にも適用できる制度ではない。関連の政令で承認制度の対象国や対象品目を厳格に定めているからだ。従来の政令で規定していた対象国(承認制度が日本と同水準の国と政令が規定する国)は英国、カナダ、ドイツ、フランスの4カ国のみで、対象品目は新型インフルエンザのワクチンだけである。したがって米国で承認された医薬品や新型コロナ関連医薬品は特例承認の対象外であり、レムデシビルも当然、特例承認の対象外だった。新薬が本当に信頼できるものであるかは国民の生命にかかわることであり、特例承認の枠を拡大するには国民的論議を経た政令改定が不可欠だった。
ところが安倍政府は、米国政府がレムデシビルを緊急認可するとすぐさま米国に日本への安定供給を要請した。さらに2日には、持ち回り閣議(内閣総務官が閣議書を持って回り閣僚が署名する)をおこない政令を変えた。特例承認の対象に米国と新型コロナ治療薬を追加し、レムデシビルをスピード承認するためだった。さらにギリアド・サイエンシズ日本法人がまだ日本で承認申請もしていない段階から加藤厚労相は、近日中に承認の申請があるとの見通しを明らかにした。さらにギリアド・サイエンシズから申請があれば「1週間程度で承認するよう事務方に指示した」(加藤厚労相)と表明した。
こうして米国が正式な承認手続きも経ずに緊急承認した新薬を、日本における厳格な新薬審査制度を変更して、日本全国で使わせようというのである。
こうした異例の措置でレムデシビルの早期承認が実現すれば、レムデシビルは保険適用対象と認められ、日本全国の病院で使うことができるようになる。保険適用の対象外で「治験」目的でしか使えないアビガンを差し置いて、一気に全国普及することができる。それは日本の医薬品市場を米国の製薬大手が牛耳っていく可能性をはらんでいる。同時に性急な特例承認によって、全国で副作用があいつぐ危険も現実味を帯びている。
そして大きな問題は新型コロナ対応のどさくさに紛れて、日本の医療界、医薬品業界、研究者などが築き上げてきた新薬承認の基準を閣僚のみの判断で崩して政令を改定し、特例承認対象国に米国を追加したことである。それは今後、世界的規模の感染症が起き、治療薬やワクチンが必要になったとき、いつでも米国製新薬への特例承認を適用していく地ならしにほかならない。
新型コロナウイルスの治療薬を早急に開発することは日本国内の誰もが待ち望んでおり、そのために必要な制度変更は積極的に推進すべきである。だがレムデシビルを巡る動きは、国民の生命を救う目的とは別の思惑が見え隠れしている。






















いつも質の高い記事をご提供下さり有難う御座います。”アビガン承認拒否”の一件では誰が見てもトンチンカンな政府の説明・対応に憤りがおさまらず、厚労省の吉田淳さんにもメ-ルで抗議し彼から回答を貰いましたがいまだに納得出来ません。いつになったら”卑屈なポチ”は独り立ちするのやら。貴社には連休明けにカンパさせて頂きたく存じますが、郵便局から振り込む際、口座(01540xxxxx8)の名義人は長周新聞社で宜しいでしょうか。
けいこ
厚生労働省の検査基準は、重篤化しない感染者をウイルスキャリアとし、コロナウイルス蔓延を助長させ、検査基準に達せず、自宅療養する感染者の急激な重篤化で死亡させた。厚生労働省が異例の速さで、アメリカレムデシビルを薬事承認し、アビガンを承認しないことは、コロナウイルスを感染検査基準で十分に感染させ、増殖するのを待つ目的と解釈できる。ウイルス感染、増殖蔓延すると、アビガンでは対応できず、レムデシビルが売れる。厚生労働省はこれまで、薬害エイズ、血液製剤や子宮頸がんワクチンなどの利権団体との癒着がある。国民の健康、生命を守るという観点よりも製薬会社との癒着、天下り先確保。そのための検査しない検査基準と解釈できる。早期検査、ウイルス増殖前にアビガン飲むと治るコロナ。もうすでにコロナ撃退方法はあるのに、未だに増えない検査数。不可解な厚生労働省。
米国大手製薬会社ギリアド・サイエンシズは5日、レムデシビルを少なくとも2022年末まで欧州、アジア、途上国向けに生産するために化学メーカーや製薬会社と協議に入っていると明らかにした。このギリアドに嘗て国防長官だったラムズフェルドが会長におさまり後ろ盾となっていたのだ。従って、今回も米国からの圧力が掛かり日本のアビガンは後退させられてしまった。その中で、現在注目され出したのが、北里大大村教授が開発したイベルメクチンだ。
イベルメクチンは2015年のノーベル生理学医学賞を受賞した大村智先生が発見した。寄生虫(鉤虫、回虫、肺線虫、糸状虫などの線虫類)に対して極めて有効に作用し、1981年から人体に先駆けて動物用駆虫薬として、ウマ、イヌ、ウシなどの動物に使用されている。
日本では最初にウマの線虫(大円虫、小円虫、馬回虫)用の駆虫薬として販売され、その後、イヌの飼い主を悩ませていた犬糸状虫症(フィラリア症)の予防薬として承認された。一方、医療に対してもヒトのオンコセルカ症に対しても極めて有効なことが明らかとなり、さらに東南アジア、太平洋地域、中東、アフリカから中南米の熱帯地域に多数の患者がいるリンパ性浮腫と象皮症を主徴とするリンパ系フィラリア症、東南アジアなどの熱帯・亜熱帯地域で流行している皮疹や肺症状、下痢を伴う腹痛などの症状を示す糞線虫症やヒゼンダニの寄生によるヒトの疥癬の治療にも優れた効果があることが明らかとなり実用化されている。
なお、大村教授に授与されたノーベル生理学医学賞の受賞理由は、世界的に人類を苦しめている線虫の寄生によって引き起こされる感染症に対する新たな治療法の発見に対してだった。
2020年1月~3月に北米や欧州、アジアの169の医療機関でイベルメクチンを投与された約700人の患者と、投与されず別の薬などによる治療を受けた約700人の死亡率を比較した成績が報道された。その結果、イベルメクチンを投与していない患者の死亡率は約8%だったのに対し、投与した患者は約1%と低かったとされています。また、人工呼吸器が必要な重症者の死亡率をみると、投与していない患者で約21%なのに対し、投与した患者では約7%とイベルメクチンの治療効果を述べている。
以上、最初に動物薬として承認されたイベルメクチンがコロナ治療薬候補として注目されている。イベルメクチンはすでに人体にも使用され安全性も確認されている薬剤であることから、有効性が確認されれば広く応用されるものと期待される。