次第に気温が下がり、秋・冬への移行期を迎えるなか、新型コロナウイルスの本格的な第二波に備える対策が世界各国で始まっている。一般的に高温多湿の夏に比べ、気温が低く、空気が乾燥する冬になるとウイルスの活動は活発になり、感染力が増す。新型コロナとインフルエンザとの同時流行への警戒感も高まっており、各医療機関ではインフルエンザワクチンの確保に追われている。一方で、待望される新型コロナのワクチンをめぐり、世界の製薬大手による開発競争が過熱し、安全性を担保する臨床試験を大幅に短縮しながら、科学的なデータがないまま政府承認が先行していることへの危惧も強まっている。ワクチンの完成が望まれているものの、有効性と安全性がともなわなければ意味がない。過熱するワクチンビジネスの現状について考えてみたい。

臨床試験を極端に短縮
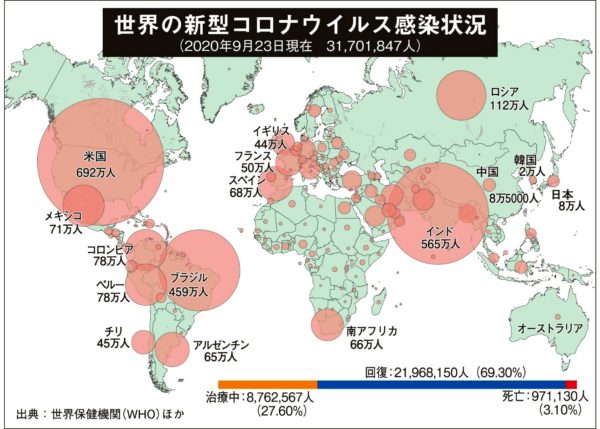
世界保健機関(WHO)によると、開発中の新型コロナのワクチン候補は9月17日時点で182種類にのぼり、そのうち人に投与する臨床試験(治験)を始めたものは36種類ある。先行しているのは、アストラゼネカ(英国)、ファイザー(米国)、ビオンテック(独)、カンシノ(中国)、モデルナ(米国)、シノバック(中国)、ガマレヤ研究所(ロシア)、シノファーム(中国)などで、9社が三段階ある治験の最終段階に入っているとされる。
予防接種などで使われるワクチンは、ウイルスや細菌などの病原体が持っている病原性を不活化したり、弱毒化したものを接種することで病原体に対する免疫(抵抗力)をつくり出し、病気になりにくくするためのものだが、これによって感染を完全に遮断したり、ウイルスを根絶できるわけではない。
人類史上ワクチンによって完全に根絶できた感染症は天然痘だけであり、それも1980年のWHOによる世界根絶宣言までに200年の歳月を要した。それ以外のポリオ、破傷風、水疱瘡、おたふく風邪、結核、インフルエンザなどの感染症は、ワクチンを使用することで予防し、共存している状態だ。
インフルエンザではワクチンの効果は「重症化予防を期待」されるレベルで、社会的防衛効果は否定されている。またウイルスが毎年変異をくり返して多くの亜型に分かれているため、過去の傾向から来期流行の型を予想してワクチンが製造されているが、その有効率は20~60%に止まる。免疫の持続期間にも幅があり、接種1~2週間後から抗体が上昇し、2回目の接種から1カ月がピークとされている。
一般的に感染症のワクチンを開発し、安全性を確認して実際に臨床で実用化するまでには、5~15年の期間が必要とされる。今までの最短記録である流行性耳下腺炎(おたふく風邪)のワクチンでさえ4年を要した。
ワクチンは、ウイルスなどの病原体を元につくられるため、副作用などのリスクも高く、ワクチン接種後にウイルスに自然感染したさい、ワクチン接種でつくられた「悪玉抗体」が逆にウイルスを細胞内に誘導し、感染を促進してしまう抗体依存性免疫増強(ADE)と呼ばれる症状など深刻な副作用もある。実際、新型コロナに近いSARSの動物実験や、フィリピンで多くの子どもが感染したデング熱では、この副作用による多数の死亡例が報告されている。基本的に健康な人に対して使用されるものであるため、製造過程は他の医薬品と比べても厳しい基準と慎重さが求められる。
そのためワクチン開発過程は、抗原の抽出や遺伝物質を合成して開発品のタイプを決める基礎研究を経て、
①モデル動物を用いて安全性や有効性などを分析・評価する非臨床試験(約6カ月)
②小規模な被験者でヒトへの安全性を評価する第一相臨床試験(約1年6カ月)
③投与量や投与回数を検討する第二相臨床試験(約1年)
④大規模な被験者を対象に感染症の流行地域で有効性を評価する第三相臨床試験(約2年)
という長いステップを踏む必要がある。そこから各国の規制当局による審査を経て、承認を取得した後も、商業生産に向けた生産体制の整備をおこなって接種開始までに約5年はかかるのが一般的だ。
だが現在、新型コロナのワクチン開発は、非臨床試験を含む①~④までの臨床試験と承認・供給までの期間をわずか1年間に短縮するという未曾有のスピードで進行している。
新型コロナのようにRNAなど遺伝子を使って作るワクチンは、ウイルスを培養するなどの手間がかからない「遺伝子組み換えワクチン」であるため従来型より開発期間を短くできるといわれるが、ヒトに実用化された例はなく、有効性や安全性の検証などハードルは高い。通常、ワクチンの臨床試験の成功率は10%程度に過ぎず、効果が認められなかったり、副作用の発生によって供給されないケースが大半だ。にもかかわらず開発開始から半年にも充たないうちに臨床試験に入り、通常なら数年かけておこなわれる安全性の確認がされないまま製造過程に入るという異次元の開発工程となっている。
大統領選前に急がせるトランプ 政治的思惑絡み
英オックスフォード大学が開発中のワクチンについてライセンス契約している英製薬大手アストラゼネカは、国際的な生産体制を増強中で、開発に成功すればイギリスだけでも1億回分、世界全体では20億回分のワクチンを提供すると早くから表明している。ワクチンの臨床試験はすでに最終段階に入り、7月と9月に英国での治験参加者に神経性の疾患があらわれて一時中断したものの、「ワクチン投与とは無関係」として試験を再開し、2020年中の供給を目指している。
米国の製薬大手ファイザーとモデルナも7月27日から最終段階の臨床試験に入っている。ファイザーは、早ければ10月中にも同社製ワクチンの使用許可や承認を申請する方針を明らかにした。米国の食品医薬品局(FDA)は第三段階の治験終了を待たずにワクチンを特例承認する可能性を示唆している。
米トランプ政府は、来年1月までに3億回分のワクチン確保を目指しており、これに歩調を合わせるようにCDC(米国疾病対策センター)が各州当局に対して接種の準備を11月1日までに整えるように通達を出している。この日程は11月3日に実施される大統領選の2日前にあたり、政治的な圧力を背景に急ピッチで動いている。
ワクチンのスピード開発の背景にあるのが、国家ぐるみの開発費支援だ。世界最大の感染国である米国では、3月下旬にまとめた追加予算のうち100億㌦(約1兆7000億円)を投入。英アストラゼネカに対しては、米国が12億㌦(約1284億円)を投資して3億回分を確保する約束をとり付け、英国も6550万ポンド(約85億円)を投資して1億回分を確保した。米国政府はさらに米ノババックスに16億㌦(約1712億円)、モデルナに5億㌦(535億円)など、巨額の資金提供の見返りに供給量を確保する動きに出ており、独キュアバックには同社開発ワクチンの独占権までを提案して物議を醸した。
また、中国政府は、感染症対策として1兆元(約15兆円)の特別国債を発行して自国の研究開発に投じ、7月からは医療従事者や検疫担当者らを対象に例外的な緊急投与を開始。ロシア政府も、国内製薬大手のガマレヤ研究所のワクチン臨床試験が第二段階までしか終わっていない8月時点で正式に承認し、11月以降、医療従事者などを対象に集団接種を開始する方針を発表している。だが両国のとりくみは例外とみなされ、WHOが人間対象の広範な治験の段階に達したと認めるワクチン候補の中には含まれていない。
7月にはワクチン開発のスパイ疑惑を理由に、米国が在ヒューストン中国総領事館を閉鎖し、対抗措置として中国側も成都のアメリカ総領事館を閉鎖するなど、外交問題が絡んだ場外乱闘の様相にもなっている。
だが、そもそも通常必要な臨床試験を経ず、効果も安全性も不確かなワクチンの大量購入や集団接種を国家レベルで進めることは、壮大な人体実験にほかならない。未知のウイルスに不安を持つ人々の心理につけ込んで、安全性を確認するに足る充分な臨床試験を経ない特例承認に世界的な批判が高まり、米国での直近の世論調査(CBS)では、年内で可能となった場合にワクチンを「接種する」と解答した人は21%に止まった。
そのためアストラゼネカ、モデルナ、ファイザー、ジョンソン・エンド・ジョンソンなどワクチン開発で先行する欧米の大手9社は連名で「安全性と接種者の健康を最優先する」「科学的なプロセスを順守する」と異例の声明(9月8日)を出し、懸念払拭に躍起になっている。
副作用の損失肩代り 五輪願望する日本政府
世界のワクチン市場は、約3・95兆円規模(2018年)といわれ、2027年までには6・9兆円にまで膨らむと予測されている。現状の企業別シェアは、英グラクソ・スミスクライン(GSK)が24%、米メルクが21%、米ファイザーが17%、仏サノフィが17%で、欧米4社だけで8割を占める寡占市場だ。
新型コロナのワクチンの普及で市場はさらに拡大するとみられ、定期接種となれば毎年のように莫大な利益が得られる。接種人口も把握できるため生産計画も立てやすく、在庫処分に困ることもない。いざ接種によって健康被害が起きても、接種の可否は行政の決断なので製薬会社の責任が回避されるケースも多い。製薬会社にとっては至れり尽くせりのビジネスであり、各製薬メーカーが社運を賭けてしのぎを削る大きな理由の一つだ。この企業利益に、コロナ抑制を政治的レガシーにしたい各国為政者の思惑や経済事情が絡み合って、未曾有のワクチン開発合戦が過熱している。
来年7月に延期した東京五輪・パラリンピックの開催を願望する日本政府も例外ではない。
安倍政府(当時)は9月8日、「令和3(2021)年前半までに全国民に提供できる数量(のワクチン)を確保することを目指す」との目標を掲げ、2020年度予算の予備費のうち約7000億円をワクチン取得費にあてることを閣議決定した。
国内では、大阪大とバイオ製薬ベンチャー「アンジェス」がDNAワクチンの臨床試験に入り、大手も開発に着手しているものの臨床試験開始は来年3月とみられ、世界の開発競争では遅れをとっている。政府は今年8月、武田薬品工業に301億円、塩野義製薬に223億円、アンジェスに94億円、KMバイオロジクスに61億円、第一三共に60億円、アストラゼネカ日本法人に162億円の6社合計9000億円余りの助成を決めた。
さらに五輪開催前にワクチン供給を間に合わせたい日本政府は、海外で使用された医薬品を国内での臨床試験をせずに厚労相の権限で緊急承認できる「特例承認」を視野に、海外メーカーからとり寄せる方向にシフトし、アストラゼネカから1億2000回分(約2600億円相当)、米製薬大手ファイザーと独ビオンテックから2021年6月末までに1億回分のワクチンを約20億㌦(約2140億円)で取得することで基本合意した。1回あたり約19・5㌦(約2089円)で、1回接種で1人あたり約40㌦(約4200円)のコストは、新型インフルエンザワクチンとほぼ同じとされている。
さらに日本政府は「早期にワクチンを供給する環境を整える必要がある」として、ワクチン接種による副作用や副反応で健康被害を受けた場合、民事訴訟などによる製薬会社の損失を国が補償する方針を固めている。製薬会社が負うべき補償を政府が肩代わりするというもので、日本への供給に関して製薬会社は安全性のリスクを考慮する必要がなくなる。売り手市場となったワクチン確保交渉において、製薬メーカーの要求を丸呑みした片務的な契約だが、菅政府はこれを獲得競争におけるセオリーと見なして関連法案を次期国会に提出する見通しだ。
さらに日本政府は、欧米では公表されている「開発のガイドライン」を公表していない。海外製のワクチンを国内で使用する場合、欧米では日本での承認に必要な臨床試験の開始や承認申請に通常必要となる非臨床試験が一部免除されているものも多く、その安全性を検証する必要がある。また、遺伝子組み換えワクチンでは、承認前検査の実施のためにカルタヘナ法(遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律)上の大臣確認が必要となり、そのための準備に多大な時間がかかる。それらの検証を丸ごと免除し、副作用や後遺症の問題さえも国が肩代わりして野放しにするというのでは、ワクチンに対する信用は低下せざるを得ない。
過去にも副作用や大量廃棄
新型インフルエンザ(H1N1)が流行した2009年にも各国は大量のワクチンを高額で購入したが、結局は使いものにならず大量に廃棄した前例がある。このさいも製薬大手が効果や副作用について充分な検証をしないままワクチンを販売し、副作用についての責任を各国政府に転嫁する条件を付けた。ワクチンの国費購入を奨励したWHOは、後にこのワクチンの一種を接種した子どもや若者が突然睡眠状態に陥る副作用が12カ国で報告されていると発表。フランスでは、H1N1による死者は312人だったものの、政府は9400万回分ものワクチンを購入し、その後5000万回分をキャンセルし、2500万回分を廃棄した。
日本政府も09年にH1N1対策として、国産ワクチン5400万回分(約210億円)、英GSKや米ノバルティスなどから輸入ワクチン6700万回分(約853億円)を政府が買い上げたが、後に国産ワクチン3100万回分、輸入ワクチンのほとんどを廃棄している(2011年5月23日・参議院決算委員会議事録)。
米国では今年4月、FDAがトランプ米大統領が推奨した抗マラリア薬「ヒドロキシクロロキン」をまともな治験をせぬまま新型コロナの治療薬として緊急承認し、数百万回分を全国の病院に配布したところ、有効性が認められず、むしろ各地で投与した患者に失神、心停止、突然死といった致命的な副作用が出たことが判明。6月に承認を取り消すという大失態を経験している。
また8月にも、大統領が「致死率が35%減る」と主張した新型コロナ回復者の血液中の成分(血漿)を患者に投与する治療法を、FDAがデータ不十分なまま緊急承認し、世界の不信を買った。
ワクチン待望論とともに過熱する製薬会社の開発レースや、東京五輪など特定企業や政治的な利権が絡む目的達成のために、国民の生命の安全を顧みないワクチンの拙速な承認は逆に社会全体に混乱をもたらさざるを得ない。優先的に接種対象となる医療従事者が「最初の実験台」となる危険性すらある。
むしろ、いまだに無症状者は保険適用外のままであるPCR検査の制度を見直し、誰でもいつでも無料で受けられるようにするなど公共の検査体制や生活保障制度を拡充しつつ、科学的な知見に基づいた臨床試験で安全性が担保されたワクチンを供給することが求められている。